
V článku se dozvíte:
1. V ČEM JE ROZDÍL MEZI organické a anorganické formě JÓDU
2. PROČ zařadit JÓD V SOLI MEZI ANORGANICKÉ (neživých) LÁTKY
3. ŽE LZE AJ v laboratoři VYTVOŘIT organicky (živou) sloučeninu
4. PROČ JSOU ORGANICKÉ SLOUČENINY LEPŠÍ
5. PROČ SE TAKÉ V mořských řas NACHÁZÍ JÓD V anorganického (neživých) FORMĚ
6. PROČ JSOU PRODUKTY Joda ORGANIKA® JEDINEČNÉ
V praxi se často setkáváme s nejistotami kolem anorganické a organické formy jódu. Vrátíme se proto k základům anorganické a organické chemie a schematicky rozebereme rozdíly ve fyzikálních, chemických i biologických vlastnostech těchto forem jódu.
Chci vědět víc o organickém jodu
ANORGANICKÁ FORMA JÓDU
HALOGÉNY

Jód spolu s dalšími prvky, kterými jsou: fluor, chlor, brom a radioaktivní astat patří do skupiny halogen. Halogeny se nacházejí v 17. skupině periodické soustavy prvků. Ve svých atomech mají sedm valenčních elektronů, všechny jsou nekovy. Halogeny se za běžných podmínek vyskytují jako dvouatomových molekuly X² ve kterých jsou atomy vázány jednoduchou nepolární vazbou. Všechny halogeny jsou toxické. Jód jako halogen je tmavě šedá tuhá krystalická látka, která sublimuje. Páry jódu jsou fialové a toxické. Atomy halogenů mají velké hodnoty elektronegativity.
SLOUČENINY halogen
Mezi nejvýznamnější sloučeniny halogenů patří Halogenovodíky, halogenidy, oxidy, kyslíkaté kyseliny a jejich soli.
Většina halogenů je rozpustná ve vodě. Halogeny se v přírodě díky své reaktivitě nevyskytují volné. Vyskytují se vázané v halogenidů. Soli halogenovodíkových kyselin se nazývají halogenidy obsahující anion X-. Jsou to dvouprvkové sloučeniny halogenů s prvky s menší hodnotou elektronegativity. Jejich názvy se tvoří příponou -id; chlorid, fluorid, bromid, jodid.

Jodid je sůl Kyselina Jodovodíková (HI). Nejznámějším zástupcem je jodid draselný (KI). Nositelem účinku je jodidový iont. Jód v něm zajímá podobu iontu I-. Jodid draselný (KI) je anorganická sloučenina jódu a draslíku. Tato bílá sůl je komerčně nejvýznamnějším jodidem, v roce 1985 činila celosvětová roční produkce zhruba 37 tisíc tun.
Protože je jodidový iont slabým redukčním činidlem, I- se silnými oxidačními činidly (např. Chlorem) snadno oxiduje na jód: 2 KI (aq) + Cl2 (aq) → 2 KCl + I2 (aq) Tato reakce se využívá při izolaci jódu z přírodních zdrojů. Jodid draselný je oxidovaný i vzduchem, jak lze dokázat pozorováním fialového extraktu, oplachu staré vzorky jodidu draselného dichlormethanem.
ORGANICKÁ FORMA JÓDU
Rozdělení chemie na anorganickou a organickou má historické důvody. V minulosti se chemické sloučeniny rozdělovaly podle původu na anorganické (související s neživou přírodou) a organické (související s živou přírodou - rostlinné a živočišné). Název organické chemie vyplynul z představy, podle níž organické sloučeniny mohou vznikat pouze v buňkách živých organismů. Ještě v první polovině 19. Století se vědci domnívali, že na tvorbu organických sloučenin je nutná tzv. životní síla (z latinského vis vitalis), a proto je nelze připravit v laboratoři. Tuto představu vyvrátil německý chemik F. Wöhler, který jako první připravil organické sloučeniny v laboratoři.

Organická chemie je chemie sloučenin uhlíku. Molekuly organických sloučenin jsou složeny z atomů poměrně malého počtu prvků. Kromě uhlíku je zejména vodík, který je přítomen téměř ve všech organických sloučeninách, kyslík a dusík. Tyto tři prvky někdy označujeme jako organogénne prvky. V organických sloučeninách se často vyskytují i halogeny, mezi které patří jód.
Organické sloučeniny mají na rozdíl od anorganických odlišnou strukturu ale i odlišné fyzikální, chemické i biologické vlastnosti, které vyplývají ze zvláštního postavení uhlíku v periodické soustavě prvků oproti ostatním prvkům.
Uhlík má v periodické soustavě prvků výjimečné postavení. Jako jediný z prvků je schopen vytvářet obrovské množství rozmanitých sloučenin od nejjednodušších s jedním atomem uhlík a ž po velmi složité, obsahující více než 100 milionů atomů uhlíku (například DNA).
Existence velkého množství organických sloučenin je dána schopností atomů uhlíku téměř neomezeně se vzájemně spojovat a tvořit stabilní řetězce. Atomy uhlíku vytvářejí mezi sebou pevné kovalentní vazby.
Atomy uhlíku vázané ve sloučeninách nemají volné valenční elektronové páry ani orbitaly. V jeho valenční vrstvě se nacházejí čtyři elektrony, přičemž všechny se podílejí na tvorbě chemických vazeb (vazebné elektrony) - atom uhlíku je v organických sloučeninách čtyřvazného. Uhlík má pro řetězení "výhodnou" hodnotu elektronegativity. Elektronegativita uhlíku (2,55) leží přibližně v polovině intervalu mezi elektornegativitou francia (0,7) a fluoru (4,0). Zatímco prvky s větší hodnotou elektronegativity mají snahu se redukovat (přijímat elektrony), prvky s menší hodnotou elektronegativity se snadno oxidují (odevzdávají elektrony). Proto řetězce tovrené takovými prvky nevznikají nebo jsou ve srovnání s uhlíkového řetězce méně stabilní.
V organických sloučenin převládají kovalentní vazby, tedy takové, v nichž dva navzájem se vážící atomy sdílejí společnou dvojici elektronů. Dva atomy mohou mít společných i více vazebných elektronových párů.
Organické sloučeniny se rozdělují do dvou velkých skupin uhlovodíky a deriváty uhlovodíků. Uhlovodíky jsou základní organické sloučeniny obsahující pouze uhlík a vodík. Deriváty uhlovodíků jsou odvozeny od základních uhlovodíků a kromě uhlíku a vodíku obsahují i jiné prvky (halogeny, dusík, kyslík, apod.). Atomy těchto prvků vázané v organických sloučeninách nazýváme heteroatomy.
V organické chemii existuje velké množství rozmanitých reakci. Platí pro ně tytéž zákonitosti jako pro reakce anorganických sloučenin, v důsledku odlišné a složitější struktury mají ale odlišný průběh. Obecně lze říci, že reakce organických sloučenin probíhají pomaleji než reakce sloučenin anorganických. Některé z nich lze provést jen při určitých teplotách, tlacích nebo za použití katalyzátoru. Průběh reakcí je velmi složitý a často při nich vzniká pestrá směs různých produktů. Přeměna reaktantů na produkty není jednoduchá. Uskutečňuje se přes několik dílčích kroků, které zahrnují tvorbu přechodových komplexů a také různých reakčních meziproduktů.
JODA ORGANIKA®.

Je známo, že v přírodě se jód nachází převážně v anorganické formě jako stopový prvek. Organická forma jódu je v přírodě vzácná, jejím největším zdrojem jsou mořské ryby a jejich produkty. Organická forma jódu představuje vazbu anorganického jódu na organické látky, na které se jód váže kovalentní vazbou. Zvláštností vzniku organické formy jódu u ryb je jejich neobvyklý enzymatický-metabolický systém a zajímavé vnitřní prostředí, pomocí kterého mořské ryby jsou schopny vázat anorganický jód z mořské vody na volné vazby nenasycených mastných kyselin, které vlastně produkují. Takový organický jód doporučuje používat většina odborníků, je snadno vstřebatelný a metabolizován organismem oproti anorganické formě jódu, která nejen, že se těžko vstřebává a metabolizuje, ale vyvolává i různé nežádoucí účinky, včetně alergických reakcí.
Nastavením příslušných parametrů, podmínek a prostředí, zkoumání reakčních schopností anorganické formy jodu s organickými látkami a analýzou získaných výsledků jsme vypracovali technologii a realizovali přípravu nové organické formy jódu.
POROVNÁNÍ anorganické formě JÓDU (jodid - VYRÁBĚNÉ Z MOŘSKÝCH ŘAS) A ORGANICKÉ FORMY JÓDU obsažené ve výživových dolňky Joda ORGANIKA ®
Mořské řasy jako bílkoviny rostlinného původu se vyskytují v mořích a oceánech, kde existují v symbióze s anorganickou formou jódu, která se nachází v mořské vodě ve formě jodidů. V tomto prostředí nejsou vytvořeny podmínky kovalentní vazby anorganické formy jodu s atomem uhlíku této bílkoviny, proto ani v tomto případě nemůžeme hovořit o organické formě jódu. Přítomnost jódu v mořských řasách může být pouze v anorganické formě, kterou představují jodidy.
Doplněk stravy Joda ORGANIKA® je charakterizován jako makromolekulární-organicko-jódový komplex s rozsáhlou strukturou a dlouhými uhlovodíkovými řetězci, do kterých je jód včleněn kovalentní vazbou na uhlík s volnými vazbami.

Anorganická forma jódu - jodid draselný, který ve své molekule obsahuje jeden atom draslíku a jeden atom jódu. Původně atom draslíku je nabitý kladně, představuje kation a atom jódu má záporný náboj a představuje anion. Jejich spojením, iontovou vazbou, typickou pro anorganické sloučeniny vzniká jodid draselný. Molekula jodidu draselného je elektricky neutrální, to znamená, že jód v této formě nemá žádný elektrický náboj, proto nemůže být ani biologicky aktivní.
Organická forma jódu - aktivní forma jódu, kde atom jódu mě elektrický náboj a schopnost vazby s podobně nabitými látkami, to znamená, že není neutrální a tím pádem je aktivní.
Porovnáním s jinými produkty, nová organická forma jódu ve výživových doplňcích rady Joda ORGANIKA®, neobsahuje žádné zdraví škodlivé látky. Tímto se nová organická forma jódu ve výživových doplňcích rady Joda ORGANIKA® zařadila mezi jedinečné produkty účinné při prevenci a navrácen příznivého zdravotního stavu při onemocněních způsobených narušením hladiny jódu v organismu.
Velkou předností nové organické formy jódu ve výživových doplňcích rady Joda ORGANIKA® oproti dosud používaným je to, že struktura makromolekulárních-organického komplexu je organismem velmi dobře přijímána a vstřebávána, tak jak je to u jiných produktů organického původu, ať už jde o bílkoviny, sacharidy , lipidy a jiné.
Účinnost a neškodnost výživových doplňcích rady Joda ORGANIKA® byla potvrzena iv klinické studií, v níž byly zaznamenány výhradně pozitivní výsledky, včetně dobré snášenlivosti a tolerance, bez jakýchkoliv vedlejších účinků. Ve všech sledovaných případech došlo k výraznému zlepšení zdravotního stavu.
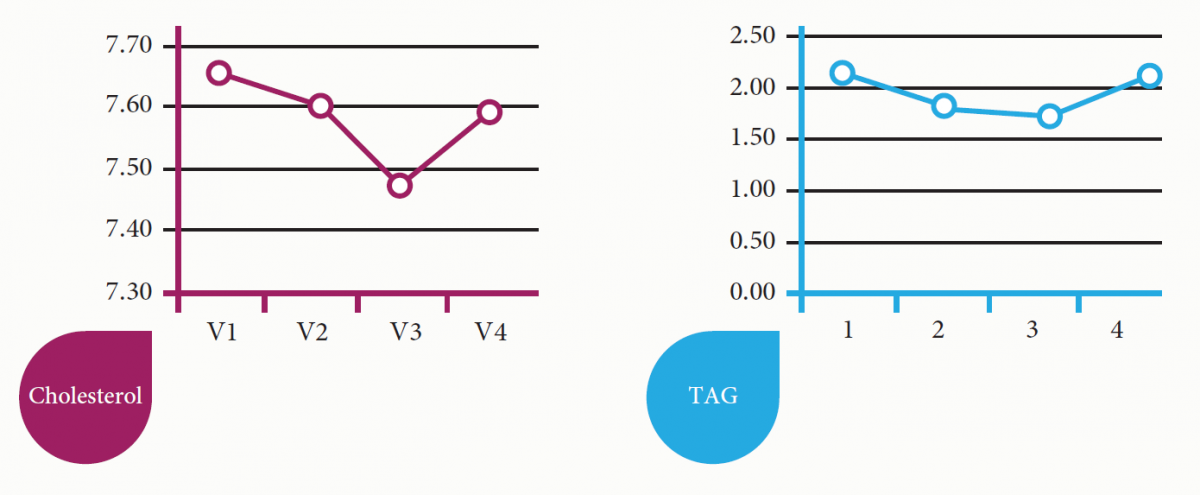
Indikace: zlepšení zdravotního stavu při poruchách hormonální činnosti, centrálně-nervového nebo kardiovaskulárního systému. Při sledování biochemických ukazatelů byla zaznamenána normalizace hodnota glukózy, cholesterolu, hormonů štítné žlázy, hormonálních poruch žen způsobených narušením menstruačního cyklu.
Naše zkušenosti potvrzují tyto údaje, neboť organismus dlouhodobě tuto dávku toleruje bez jakýchkoliv vedlejších účinků. Vycházeje z prezentovaného jsme toho názoru, že nová organická forma jódu ve výživových doplňcích rady Joda ORGANIKA®, svým složením, strukturou, účinkem se ukázala vhodným širokospektrálním prostředkem při normalizaci hladiny jódu v organismu a svými parametry jednoznačně převyšuje často neúčinné přípravky, které se na našem trhu objevují.
1./ Behrouzian R., Aghdanyi N.,: FAST MEDITERR HEALTH J. 10(2004 s. 921
2./ Borkovcova I., Řehuřkova I., : In Výživa a zdravie, 5 (2000) s. 134 – 135
3./ Boyages S.C.: In J.clin. Endocrinol. Metab, Clinical review 3 (1993) s. 587 -591
4./ Brown –Grant K.: Physiol Rev. 41 (1961) s. 189
5./ CERTEX, Cetrifikát č. 060/2010/N zo dňa 13.10.2010
6./ Delange F., Benka G., Canon Ph.: In European J. of Endocrinology 136(1997) s. 180-187
7./ Delange F., Thyroid International 3 (1994) s. 98 – 123
8./ Dvořák J.,: Serifa, 2002 s. 123
9./ Ferienčík M., Škarka B., Novák M., Turecký L., Biochémia, Bratislava (2000) s. 637-767)
10./ Golkowski F., at all: Eur J. Nutr. 46 (2007) s. 251
11./GREENWOOD, Norman Neill; EARNSHAW, Alan. Chemistry of the Elements. Oxford, UK : Pergamon Press, 1984.
12./ Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990
13./ Guy Abraham. The Wolff-Chaikoff Effect: Crying Wolf?. The Original Internist, 2005, s. 112-118.
14./ Hrnčiar J., Izakovič V., Langer P.: Klinická endokrinológia, Martin, Osveta (1982) s. 129 -211
15./ Israil L., Hajji O., Grefft – Alami A.: Proc. Asco 4 (1985) s. 58
16./ Kajaba I., Šimončič R., Gimter E.: In Výživa a zdravie 2 (1999) s. 25 -29
17./ Karlson P., Gerok W., Gross W., : Pathobiochemie, Praha (1987) s. 175 – 194, 266 – 277
18./ Klebanoff S.J.: J. Exp. Med 126 (1967) s. 1063
19./ Klimo F.: Všeobecné lekárstvo 3. Vyd., Martin, Osveta (1990) s. 871
20./ Kmeťová, Skoršepa, Mačko, Chémia pre 2. ročník gymnázia so štvorročným štúdiom, 1. vyd. Bratislava: Expol Pedagogika s.r.o., 2012. ISBN 978-80-8091-271-0
21./ Kordáč V.: In Lekárske listy 25(1999) s. 1-2
22./ Langer P., Sigmuntová V., Kaplanová V.: In Bratislavské listy 11(1995) s. 613 – 616
23./ Lanmger P.: In Lekárske listy 4 ( 1995) s. 183 – 191
24./ Leroy G. Wade, Organic Chemistry, 5th ed., pp. 871-2, Prentice Hall, Upper Saddle RIver, New Jersey, 2003. ISBN 978-0-130-33832-7
25./ Ma F., Zhao W., Kudo M., Aoki K., Misumi J.: Toxicol in Vitro 16 ( 2000) s. 531
26./ Marani L., Venturi S., Masula R.: Isr. J. Med. Sci. 21( 1985) 864
27./ March Jerry, Advanced Organic Chemistry, 4th ed., pp. 670-1, Wiley, New York, 1992. ISBN 0-471-60180-2
28./ McCance; Huether. Pathophysiology: The biological basis for disease in Adults and Children. 5th Edition. Elsievier Publishing
29./ Mc Ginness J.E., Grossie B., Proctor P.H.: Physiological Chemistry and Physics and Medical 18 (1986) s 17 – 24
30./ Nemec J., Zmrazil V., Vaňa S.: Avicenum, Praha (1991) s. 138 – 139
31./ Nemeth Š., Podoba J.: In Bratislavské lekárske listy 1 ( 1995) s. 13 – 21
32./ Oravec S., Oravec D., Dielplinger H.: In Vnitřní lékažství 1 (1998) s. 8 -12
33./ Patrick I.: Altern. Med. Rev. 13(2008) s. 116
34./ Phyllis A. Lyday "Iodine and Iodine Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim
35./ Podoba J.: In Recipe 3-4 (1999) s. 72-77
36./ Spitzweg C., Joba W., Eisenmenger W., Heufelder A.E.: J. Clin. Endocrinol. Metab. 83 (1998) s.1746
37./ Stoddard F.R., Brooks A.D., Eskin B.A., Johannes G.J.: International Journal of Medical Science 5 (2008) s. 189
38./ The Merck Index, 7th edition, Merck & Co., Rahway, New Jersey, 1960
39./ Venturi S., Venturi M.: Nutrition, 25 (2009) s. 977 – 979
40./ Venturi S., Venturi M., Cimini D., Arduini C., Venturi M., Guidi A.: Europ. J. Cancer. Prev. 2 (1993) s. 17
41./ Vohlídal, Jiří; Štulík, Karel; Julák, Alois. Chemické a analytické tabuľky. 1. vyd. Praha : Grada Publishing, 1999. ISBN 80-7169-855-5.
42./ Witt E.H., Reznick A.Z., Vigule Ch.A.: J. Nutr. 122 (1992) s. 766 – 773
43./ Zmrazil V., Čeřovská J., Bílek R.: In Bratislavské lekárske listy 11 ( 1995) s. 609 -613
44./ Youngson R.: Antioxidanty cesta ke zdraví, Brno (1998) s. 42 – 43
45./ Úradný vestník EÚ L 276, Smernica rady ES č. 31990 L 0496 zo dňa 6.10.1990 určenie denných dávok minerálov a vitamínov
46./ Úradný vestník EÚ L 279/13, Nariadenie komisie EÚ č. 957/2010 zo dňa 22.10.2010 o povolení určitých zdravotných tvrdení o potravinách, ktoré odkazujú na zníženie rizika ochorenia a na vývoj a zdravie detí
47./ Úrad verejného zdravotníctva SR, Rozhodnutie č. OHVBPKV/5661/2010 zo dňa 20.8. 2010
Externý odkaz
World Health Organization's guidelines for iodine prophylaxis following a nuclear accident
